Os ácidos e as bases são duas funções químicas que são consideradas opostas, isso porque as suas propriedades costumam ser inversas.
Por exemplo, se considerarmos alimentos presentes em nosso cotidiano que são ácidos, veremos que o gosto deles, no geral, é azedo, como ocorre com o limão.
Porém, alimentos que são básicos possuem gosto adstringente (que “amarra” a boca), como o de uma banana verde.
SOLUBILIDADE EM ÁGUA
Os ácidos costumam ser bem solúveis em água, enquanto a maior parte dasbases é insolúvel.
As bases de metais alcalinos são solúveis, a de metais alcalinoterrosos são pouco solúveis e as bases de outros metais são insolúveis (uma exceção é o hidróxido de amônio, NH4OH .
CONDUTIBILADE ELÉTRICA
Todos os ácidos só conduzem corrente elétrica quando estão dissolvidos em água, porque quando estão em meio aquoso, eles sofrem ionização, ou seja, liberam íons.
Todas as bases também conduzem corrente elétrica em solução, pois as iônicas sofrem dissociação (liberam os íons já existentes na fórmula) e as moleculares sofrem ionização, reagindo com a água e liberando íons. As bases de metais alcalinos também conduzem corrente elétrica quando estão no estado líquido (fundidas).
Ação em relação aos indicadores:
Os indicadores ácido-base são substâncias naturais ou sintéticas que sofrem uma alteração em sua cor quando entram em contato com um ácido ou uma base.
Se um ácido provoca a alteração da cor do indicador, a base fará o indicador voltar à cor original e vice-versa.
Por exemplo, a fenolftaleína é um indicador ácido-base muito utilizado, sendo que, em meio básico, ela fica um rosa bem intenso; já em meio ácido, ela fica incolora.
O papel de tornassol também é um bom indicador, sendo que em um ácido, ele fica vermelho; e em uma base, ele fica azul.Isso serve também para indicar a diferença de pH que há entre os ácidos e as bases.
PH:
Um meio considerado neutro possui pH igual a 7, como é o caso da água destilada.Os ácidos possuem pH menor que 7, enquanto as bases possuem pH maior que 7.
Exemplos de soluções com pH próximo ao indicado pela escala:
Quando colocados em contato, os ácidos e as bases reagem entre si, neutralizando um ao outro, isto é, tornado o pH do meio neutro. Isso ocorre porque o cátion H+ proveniente do ácido reage com o ânion OH- proveniente da base, formando água.
Esse tipo de reação é chamado de reação de neutralização e produz também um sal.
NOMENCLATURA
ÁCIDOS :
Para ácidos não oxigenados, usamos a terminação IDRICO.
Exemplo:
• HCl – ácido clorídrico
• H2S – ácido sulfídrico
• H2Se – ácido selenídrico
• H2S – ácido sulfídrico
• H2Se – ácido selenídrico
Para ácidos oxigenados, a coisa complica um pouco.
Se o elemento possuir somente uma valência,usamos a terminação ICO.
Exemplo:
- H2CO3 – ácido carbônico
- H3BO3 – ácido bórico
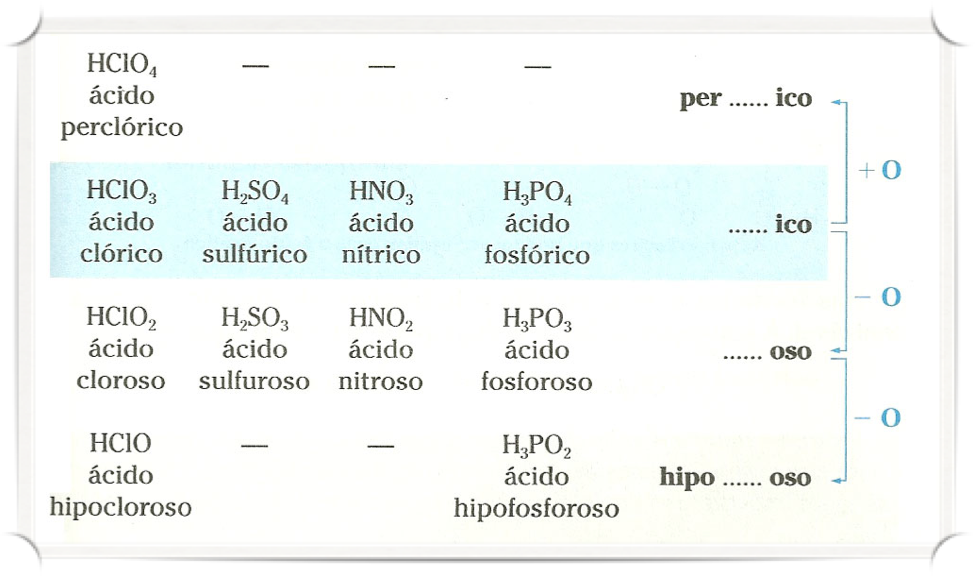
Se o elemento tiver 2 valências, para a maior usamos ICO e para a menor OSO.
Exemplos:
- H2SO3 – ácido sulfuroso
- H2SO4 – ácido sulfúrico
- HNO2 – ácido nitroso
- HNO3 – ácido nítrico
Se o elemento tiver 3 ou mais valências, usamos o prefixo HIPO junto com o sufixo OSO, e o prefixo PER junto com o sufixo ICO, nesta ordem.
Exemplos:
- HClO – ácido hipocloroso
- HClO2 – ácido cloroso
- HClO3 – ácido clórico
- HClO4 – ácido perclórico
Existem casos em que o elemento forma diversos ácidos, porém sempre com a mesma valência.Usamos então os prefixos ORTO, META e PIRO.
Exemplos:
- H3PO4 – ácido ortofosfórico
- HPO3 – ácido metafosfórico
- H4P2O7 – ácido pirofosfórico
Note que nos três ácidos o fósforo tem valência +5.
BASES
Se o elemento possuir somente uma valência, usamos a expressão “hidróxido de” seguida do nome do elemento. Exemplo:
- NaOH – hidróxido de sódio
- Ca(OH)2 – hidróxido de cálcio
Se o elemento possuir duas valências, usamos a expressão “hidróxido de” seguida do nome do elemento e os sufixos OSO e ICO, ou então a valência em números romanos. Exemplo:
- Fe(OH)2 – hidróxido ferroso ou hidróxido de ferro II
Fe(OH)3 – hidróxido férrico ou hidróxido de ferro III
FONTES:
http://www.brasilescola.com/quimica/comparacao-entre-acidos-bases.htm
Se o elemento possuir somente uma valência, usamos a expressão “hidróxido de” seguida do nome do elemento. Exemplo:
- NaOH – hidróxido de sódio
- Ca(OH)2 – hidróxido de cálcio
Se o elemento possuir duas valências, usamos a expressão “hidróxido de” seguida do nome do elemento e os sufixos OSO e ICO, ou então a valência em números romanos. Exemplo:
- Fe(OH)2 – hidróxido ferroso ou hidróxido de ferro II


Nenhum comentário:
Postar um comentário